|
pP1C.7单子叶植物双敲载体
收藏
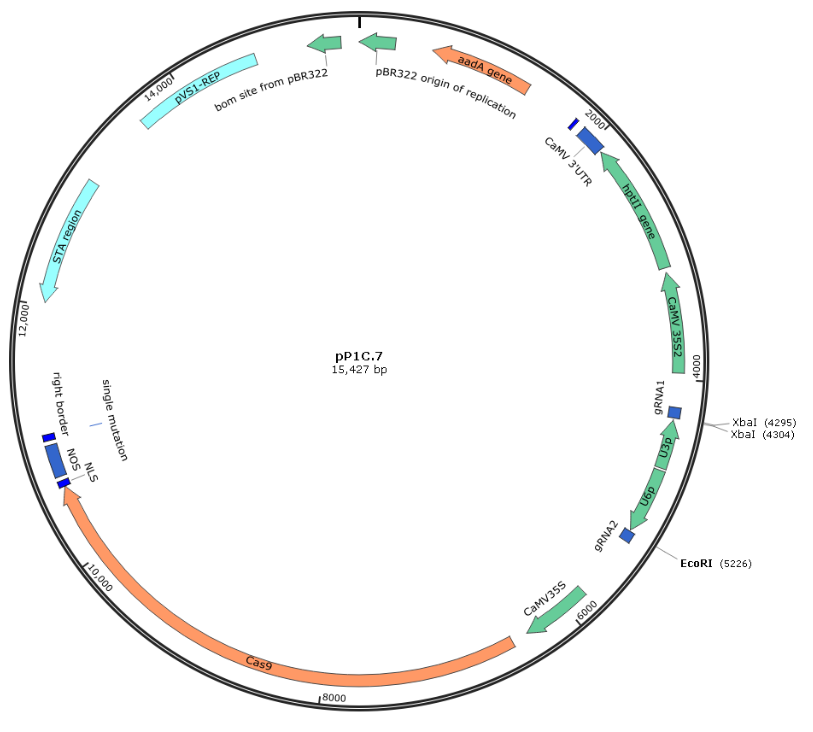
❀pP1C.7质粒图谱
5’_AAACAGCTATGACATGATGGTACCGGTTCACTAAACCAGCTCTAAAAAAGCACCGACTCGGTGCCACTTTTTCAAGTTG
KpnⅠ位点:GGTACC 灰色底纹标示的序列:分别为gRNA1、gRNA2 XbaⅠ切割位点:黑色方框 TCTAGAggcTCTAGA OsU3转录起始位点A的互补碱基:T 蓝色底纹标示的序列:OsU3启动子反向互补序列 绿色底纹标示的序列:OsU6启动子序列 OsU6转录起始位点:G EcoRⅠ-HF切割位点:黑色方框GAATTC HindⅢ位点:AAGCTT ❀产品规格
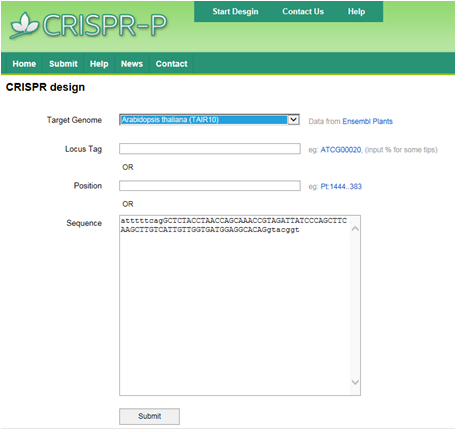
以拟南芥AtRAN1基因为例进行oligo实操设计 (1)您可以通过以下在线工具设计: CRISPR Design:http://cbi.hzau.edu.cn/cgi-bin/CRISPR (2)选取 atttttcagGCTCTACCTAACCAGCAAACCGTAGATTATCCCAGCTTCAAGCTTGTCATTGTTGGTGATGGAGGCACAGgtacggt (3)输入序列信息(以拟南AtRAN1基因为例)
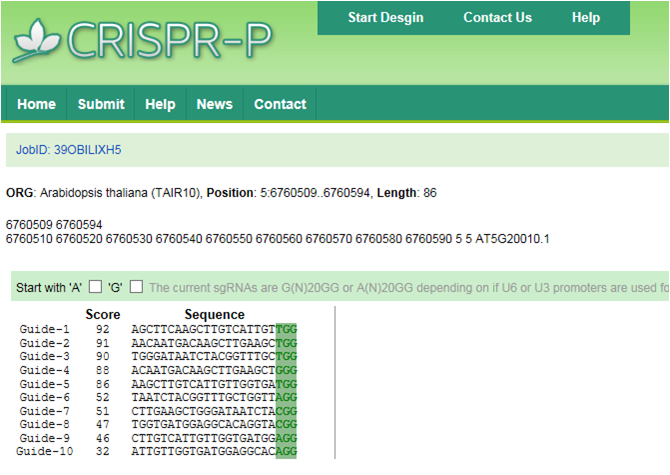
(4)点submit,出现右侧结果; (5)根据左边不同Guide序列score的高低选取合适的Guide序列,score的高低并不代表敲除效率的高低,所以为提高敲除的成功率,一般选择2-3个Guide序列,构建2-3个敲除载体。
文献资料 1.Jinek, M., Chylinski, K.,Fonfara, I., Hauer, M., Doudna, J.A., and Charpentie E. A programmabledual-RNA-guided DNA endonuclease in adaptiv bacterial immunity. Science,2012,337: 816~821. 2.Xie K, Yang Y.RNA-guided genome editing in plants using a CRISPR-Cas system. MolPlant. 2013 Nov;6(6):1975-83. 3.Nekrasov etal. Targeted mutagenesis in the model plant Nicotiana benthamiana using Cas9RNA-guided endonuclease. Nat Biotechnol. 2013 Aug 8;31(8):691-3. doi:10.1038/nbt.2655. PubMed 4.Horvath P.,Barrangou R. CRISPR/Cas, the immune system of bacteria and archaea. Science,2010, 327 (5962): 167~170. 5.Hale CR, Zhao P., Olson S.,et al. RNA-Guided RNA Cleavage by a CRISPR RNA-Cas Protein Complex. Cell, 2009,139 (5): 945~956. 6.Zhang F., et al. MultiplexGenome Engineering Using CRISPR/Cas Systems. Science , 2013, 339(6121): 819~823 7.Westra ER., Swarts DC.,Staals RH., Jore MM., Brouns SJ., van der Oost J. The CRISPRs, they area-changin': how prokaryotes generate adaptive immunity. Annu Rev Genet, 2012,46: 311~339. 8.Marraffini LA., SontheimerEJ. CRISPR interference: RNA-directed adaptive immunity in bacteria andarchaea. Nature Rev Genet, 2010, 11 (3): 181~190. 9.Jiang, W., Bikard, D., Cox,D., Zhang, F., and Marraffini, L.A. RNA-guided editing of bacterial genomesusing CRISPR-Cas systems. Nature Biotechnology, 2013, 31: 233~239. 10.Hwang WY., Fu Y., Reyon D.,Maeder ML., Tsai SQ., Sander JD., Peterson RT., Yeh JR., Joung JK. Efficientgenome editing in zebrafish using a CRISPR-Cas system. Nature Biotechnology,2013, 31:227~229 11.Barrangou R. RNA events.Cas9 targeting and the CRISPR revolution. Science. 2014, 344(6185):707~708. 12.Nishimasu H., et al. Crystalstructure of Cas9 in complex with guide RNA and target DNA. Cell, 2014,156(5)935~949.
Q&A Q-1:在进行植株的敲除载体构建前,还需要做哪些准备工作? A-1:需要目的基因的表达情况分析,为防止因染色体缺失等情况导致靶基因缺失,首先需要 PCR 扩增靶基因,并对 PCR 结果进行测序,确保靶基因的完整存在;其次,您还可以用 RT-PCR 分析靶基因的活跃度。 Q-2:植物敲除试剂盒中的质粒能否在大肠杆菌中复制扩增?若将载体构建交予你们做,怎么收费? A-2:试剂盒中的质粒能够在大肠杆菌中复制扩增,若您希望长期使用该质粒,建议在收到货后即转化至大肠杆菌中以利于长期保存和使用。敲除载体构建服务我们的收费标准是1800元/个,完成后仅提供构建完成的敲除载体和测序结果,而不提供构建的原载体以及中间载体。因敲除载体构建的特殊性,我们仅对构建的载体负责,不保证最终的敲除效果;一般的,我们建议设计2~3个不同的靶点对目的基因进行敲除。若您预期长期使用CRISPR/Cas9技术进行基因组编辑,我们推荐能购买试剂盒产品。 |