|
Cruiser®基因敲除检测试剂盒
收藏
❀产品概要 ●检测速度快:只需5~20 min,便可检测到各种类型的碱基突变,如:碱基替换、插入和缺失等; ●操作方便:无需胶回收纯化,PCR产物直接进行酶切验证; ●特异性高:精准切割突变位点,识别范围最小为1 bp的突变位点,最大可达上百bp的突变序列; ●检测方便:酶切后的PCR产物,可以通过常规琼脂糖凝胶电泳快速检测; ●混合样本分析:酶切分析混合样品(cell pool)的PCR产物,根据电泳结果计算突变率; ●高通量筛选:更加轻松地从大量样本中筛选阳性克隆。
●用于ZFN、TALEN和CRISPR/Cas9实验中混合样品的敲除效率的检测; ●用于ZFN、TALEN和CRISPR/Cas9实验中阳性克隆的筛选。 ❀产品规格
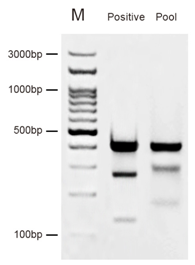
阳性对照DNA 为杂交后的DNA片段,经Cruiser®基因敲除检测错配酶切割后形成三个明显片段,分别为393 bp、134 bp、259 bp,其中134 bp和259 bp片段是酶切后片段,而393 bp片段为杂交形成的homo-duplex DNA片段,无酶切割位点,因此片段大小不变(Figure1.)。
Figure 1. 阳性对照和Pool检测的电泳结果 Figure 2. K562细胞中Atg10基因敲除案例 上图中,M:100 bp-DNA Marker; Positive:阳性对照DNA; Pool:混合克隆; Clone1-7:单克隆。
根据酶切后条带的亮度大致估测敲除效率,并送测序验证。因不同宿主物种中敲除载体的转染效率的差异,Pool验证阳性的可能性也会有较大差异,甚至存在Pool验证显示阴性,但最终却筛选到阳性克隆的情况,一般地,被转染的细胞比例越高,Pool检测越容易进行(见Figure1.)。 B. 单克隆结果分析 如上图Figure2.所示为杂交后直接酶切的结果:clone3,5和6为潜在的阳性克隆,后续直接进行TA克隆和测序验证等位基因突变情况。 进一步对上述阴性单克隆间进行两两杂交反应(例如clone1与2杂交,clone4与7杂交……),再进行酶切,步骤如前述,然后再次电泳检测,结果分析如下: ①若电泳结果显示阴性,则可判定Clone A与Clone B均为野生型,即未敲除(当然不排除Clone A与Clone B均为纯合突变型且突变后序列完全一致,但几率较小,几乎为零,所以不考虑)。 ②若电泳结果显示阳性(经验证明,这种情况几率也不是很大,此步骤能帮助筛选出两个亲本完全相同的敲除),则说明Clone A与Clone B中至少有一个为两个亲本相同KO情况的纯合突变型,此时可将Clone A、Clone B分别与野生型杂交,再进行一轮酶切验证即可,阳性克隆送测序验证突变情况。
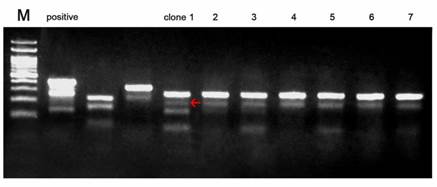
Q&A Q-1:PCR 反应后,电泳检测条带不亮,或者有杂带怎么办? A-1:建议在正式实验前先摸索好引物的PCR条件。 ①若条带不亮,则更换引物,若是因为基因本身的序列问题(如GC含量高),无法找到合适的引物, 则取第一轮PCR产物1μL,以30μL体系扩增第二轮(见下图Figure 4.),再用二轮产物进行后续的酶切实 验。或者适当增加PCR循环数,比如40 cycles。 ②若有杂带,则更换引物,若是因为基因本身的序列问题(如特异性较低),无法找到合适的引物,此 时若杂带的大小与Cruiser®基因敲除检测错配酶酶切后产生的片段大小不同,则可以直接酶切(见下图Figure 5中红箭头处的条带大小则为杂带,而它与下端的酶切条带大小不一致,不影响判断)。 ③若没有条带,则需要确认细胞是否为该物种名称的细胞,若用其它该物种的引物可以PCR出正确大 小的条带,则可以排除细胞错误的可能,需重新设计PCR用引物,或者尝试使用其它公司的高保真酶。
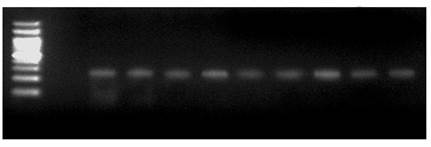
Figure 4.扩增获得目的片段一轮PCR(上)和二轮PCR(下)电泳图
Figure 5. PCR扩增目的片段有杂带,但不影响酶切的酶切电泳图 Q-2:酶切后,电泳结果仅有原片段而无酶切条带?
Q-3:酶切后,电泳结果中原片段明亮但酶切条带较弱?
Q-5:酶切后,电泳结果中酶切条带大小不是预期大小? Q-6:酶切后,如何使电泳图酶切条带更亮? Q-7:Cruiser®基因敲除检测错配酶 检测结果是否会出现假阳性? Q-8.酶切后,电泳结果中酶切条带大小与预期一致,就一定是纯合子吗? |